2026-2030年中國創新藥行業:如何突破同質化競爭與支付瓶頸?
前言
在全球醫藥產業格局加速重構的背景下,中國創新藥行業正經歷從“跟跑”到“并跑”乃至部分領域“領跑”的關鍵轉型期。2025年,中國創新藥行業迎來歷史性突破:全年獲批1類新藥數量達66款,覆蓋腫瘤、自身免疫、代謝等重大疾病領域;對外授權交易總額突破1000億美元,刷新全球醫藥交易紀錄。這一系列成就標志著中國創新藥已形成完整的研發、生產、商業化體系,并深度融入全球醫藥產業鏈。
一、宏觀環境分析
(一)政策環境:全鏈條支持體系持續完善
國家層面已構建覆蓋研發、審批、支付、國際化的全鏈條政策框架。2025年7月,國家醫保局與國家衛健委聯合發布《支持創新藥高質量發展的若干措施》,明確提出五大方向16條舉措,包括依托全國統一醫保信息平臺歸集疾病譜數據以支持研發導航、增設商業健康保險創新藥品目錄、推動醫療機構及時配備目錄內藥品等。此外,藥品審評審批制度改革持續深化,2025年國家藥監局將創新藥臨床試驗審批時限壓縮至30個工作日,較2018年縮短70%,顯著提升研發效率。
(二)經濟環境:資本與產業協同升級
中國醫藥工業主營業務收入年均增速保持9%以上,為創新藥研發提供堅實產業基礎。資本層面,2025年前三季度,中國醫藥交易對外授權總金額達920.3億美元,同比增長超150%,其中跨國藥企對早期高創新度資產的收購占比提升至40%。商業健康保險的快速發展進一步拓寬支付渠道,2025年商保創新藥目錄納入19款產品,覆蓋CAR-T、罕見病治療等高端領域,形成與基本醫保互補的支付體系。
(三)社會環境:未滿足臨床需求驅動創新
中國老齡化進程加速與疾病譜變化催生巨大未滿足醫療需求。以腫瘤領域為例,2025年國家藥監局批準的66款1類新藥中,腫瘤用藥占比超50%,涵蓋肺癌、乳腺癌等高發癌種。同時,罕見病治療領域取得突破,精準生物的CAR-T產品普基奧侖賽注射液填補國內急性B淋巴細胞白血病治療空白,打破國外技術壟斷。患者對療效更優、安全性更高的創新藥需求,成為行業發展的核心驅動力。
(四)技術環境:前沿技術賦能研發迭代
人工智能、基因編輯等技術的融合應用顯著縮短創新周期。石家莊四藥集團通過AI虛擬篩選系統,將新化合物篩選時間從2-3年壓縮至1個月,研發效率提升90%。此外,雙特異性抗體、抗體偶聯藥物(ADC)等新技術平臺成為研發熱點,2025年ADC相關交易額占對外授權總額的35%,恒瑞醫藥、信達生物等企業憑借差異化技術路線躋身全球創新藥第一梯隊。
(一)市場規模:本土需求與出海雙輪驅動
根據中研普華研究院《2026-2030年中國創新藥行業深度分析及發展前景預測報告》顯示:國內市場方面,醫保目錄動態調整機制持續發力,2025年新增114種藥品中,創新藥占比達98%,5年內新上市品種占比近90%,患者用藥可及性顯著提升。國際市場方面,中國創新藥對外授權交易呈現“高價值、多領域”特征,2025年單筆交易金額超10億美元的案例達12起,覆蓋腫瘤、代謝、自身免疫等疾病領域。據預測,到2030年中國創新藥全球市場規模將突破2萬億元,其中海外市場貢獻占比有望提升至40%。
(二)競爭格局:頭部企業引領,創新生態多元化
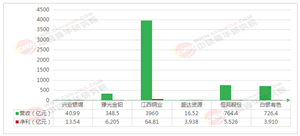
從區域分布看,長三角地區成為創新藥產業高地,上海、江蘇兩地聚集了恒瑞醫藥、信達生物、復宏漢霖等龍頭企業,形成從研發到商業化的完整產業鏈。從企業類型看,傳統大型藥企與新興生物科技公司協同發展:恒瑞醫藥憑借18款上市產品領跑行業,信達生物則通過“自主研發+國際合作”模式在腫瘤免疫領域建立優勢。此外,跨界融合趨勢顯現,2025年北京、深圳等地出臺政策支持AI醫藥研發,推動技術邊界拓展。
(三)產品結構:從“跟隨創新”到“源頭創新”
早期中國創新藥以快速跟進(Fast-follow)為主,2025年這一模式已發生根本性轉變。以ADC藥物為例,中國在研管線數量占全球近40%,且在靶點選擇、連接子設計等方面實現差異化創新。信達生物與武田制藥合作開發的新一代ADC療法,通過優化藥物抗體比(DAR)顯著提升療效,成為全球腫瘤領域標桿案例。此外,基因治療、細胞治療等前沿領域加速突破,2025年國內獲批的3款CAR-T產品中,2款由本土企業自主研發。
(一)技術趨勢:多技術融合驅動研發范式變革
未來五年,AI驅動的藥物發現、基因編輯技術、類器官模型等將深度重塑研發流程。AI技術可實現靶點預測、化合物篩選等環節的自動化,預計將研發成本降低30%以上;基因編輯技術CRISPR-Cas9在遺傳病治療領域的應用將進入臨床轉化階段,2026年后有望誕生首款基因編輯療法。同時,真實世界研究(RWD)與隨機對照試驗(RCT)的結合,將加速創新藥臨床評價與上市進程。
(二)市場趨勢:全球化布局與差異化競爭并存
中國創新藥企業將加速構建“全球研發生態”,通過“借船出海”(與跨國藥企合作)、“造船出海”(設立海外研發中心)、“自主出海”(獨立開展國際多中心臨床試驗)等模式拓展全球市場。預計到2030年,中國創新藥海外臨床試驗數量將占全球總量的25%,成為僅次于美國的第二大研發主體。差異化競爭方面,企業將聚焦未被滿足的臨床需求,在罕見病、老年病、兒童用藥等領域形成特色優勢。
(三)政策趨勢:監管科學化與支付多元化協同推進
監管層面,國家藥監局將推動藥品審評標準與國際接軌,2026年起實施“國際多中心臨床試驗數據互認”機制,縮短創新藥全球同步上市周期。支付層面,基本醫保與商業健康保險的協同效應將進一步增強,2027年前有望建立“基本醫保+商保+醫療互助”的多層次支付體系,覆蓋創新藥全生命周期成本。此外,專利鏈接制度、數據保護制度的完善,將為企業創新提供長期激勵。
(一)短期策略:聚焦高臨床價值管線
建議優先布局腫瘤、代謝、自身免疫等大病種領域,重點關注具備差異化機制(如雙抗、ADC)或技術平臺優勢(如AI驅動、基因治療)的企業。同時,關注商保創新藥目錄納入品種,這類產品通常具有高定價權與強支付能力,商業價值顯著。
(二)中期策略:布局全球化能力建設
企業需加強國際臨床試驗網絡、海外注冊與商業化團隊建設,提升全球資源整合能力。投資標的方面,可關注已建立海外合作伙伴關系或擁有國際化管理團隊的企業,這類企業在未來3-5年內更易實現價值躍升。
(三)長期策略:培育前沿技術儲備
基因編輯、細胞治療、核酸藥物等前沿領域有望催生下一代創新藥巨頭。建議長期跟蹤技術成熟度曲線,在臨床前研究階段介入具有原創性突破的項目,分享技術紅利。同時,關注政策對前沿技術的支持力度,如2025年國家科技重大專項已將基因治療列為優先發展領域。
如需了解更多創新藥行業報告的具體情況分析,可以點擊查看中研普華產業研究院的《2026-2030年中國創新藥行業深度分析及發展前景預測報告》。























 研究院服務號
研究院服務號
 中研網訂閱號
中研網訂閱號